


생명의 신비상 대상 수상자 공영윤 교수 업적 소개
공영윤 교수 서울대학교 생명과학부부
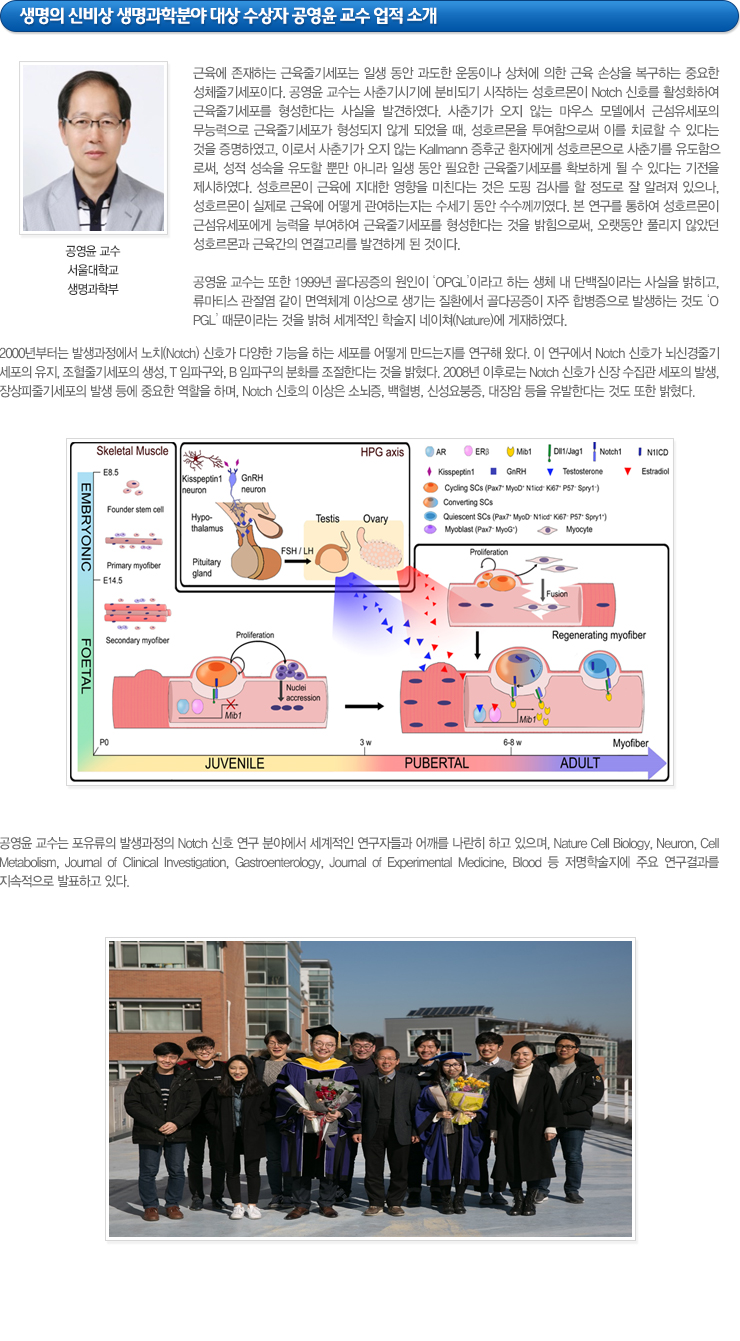
근육에 존재하는 근육줄기세포는 일생 동안 과도한 운동이나 상처에 의한 근육 손상을 복구하는 중요한 성체줄기세포이다. 공영윤 교수는 사춘기시기에 분비되기 시작하는 성호르몬이 Notch 신호를 활성화하여 근육줄기세포를 형성한다는 사실을 발견하였다. 사춘기가 오지 않는 마우스 모델에서 근섬유세포의 무능력으로 근육줄기세포가 형성되지 않게 되며, 성호르몬을 투여함으로써 이를 치료할 수 있다는 것을 증명하였고, 이로서 사춘기가 오지 않는 Kallmann 증후군 환자에게 성호르몬으로 사춘기를 유도함으로써, 성적 성숙을 유도할 뿐만 아니라 일생 동안 필요한 근육줄기세포를 확보하게 되는 기전을 제시하였다. 성호르몬이 근육에 지대한 영향을 미친다는 것은 도핑 검사를 할 정도로 잘 알려져 있으나, 성호르몬이 실제로 근육에 어떻게 관여하는지는 수세기 동안 수수께끼였다. 본 연구를 통하여 성호르몬이 근섬유세포에게 능력을 부여하여 근육줄기세포를 형성한다는 것을 밝힘으로써, 오랫동안 풀리지 않았던 성호르몬과 근육간의 연결고리를 발견하게 된것이다.
공영윤 교수는 또한 1999년 골다공증의 원인이 ‘OPGL’이라고 하는 생체 내 단백질이라는 사실을 밝히고, 류마티스 관절염 같이 면역체계 이상으로 생기는 질환에서 골다공증이 자주 합병증으로 발생하는 것도 ‘OPGL’ 때문이라는 것을 밝혀 세계적인 학술지 네이쳐(Nature)에 게재하였다. 2000년부터는 발생과정에서 노치(Notch) 신호가 다양한 기능을 하는 세포를 어떻게 만드는지를 연구해 왔다. 이 연구에서 Notch 신호가 뇌신경줄기세포의 유지, 조혈줄기세포의 생성, T, B 임파구의 분화를 조절한다는 것을 밝혔다. 2008년 이후로는 Notch 신호가 신장 수집관 세포의 발생, 장상피줄기세포의 발생 등에 중요한 역할을 하며, Notch 신호의 이상은 소뇌증, 백혈병, 신성요붕증, 대장암 등을 유발한다는 것을 밝혔다.
공영윤 교수는 포유류의 발생과정의 Notch 신호 연구 분야에서 세계적인 연구자들과 어깨를 나란히 하고 있으며, Nature Cell Biology, Neuron, Cell Metabolism, Journal of Clinical Investigation, Gastroenterology, Journal of Experimental Medicine, Blood 등 저명학술지에 주요 연구결과를 지속적으로 발표하고 있다.
생명의 신비상 생명과학분야 장려상 수상자 이주현 교수 업적 소개
이주현 교수 케임브리지 대학교 줄기세포연구소
폐는 분열 정도가 제한적이고 상처에 대한 치유능력이 없는 정적인 기관으로 알려져 왔으나, 최근 많은 연구들이 폐에도 상처에 반응해서 왕성하게 분열함과 동시에 다양한 세포들로 분화하는 능력을 가진 줄기세포와 전구세포가 존재한다는 것을 보여주고 있다. 특히나 이러한 세포들은 해부학적으로 특정한 부위에 위치하고 있으며, 상처와 손상의 부위 및 심각성 정도에 따라서 다양하면서도 특정한 세포로 분화함으로써 위치 특이적인 상처 치유와 재생 과정을 담당하는 것으로 밝혀졌다. 그렇다면, 어떻게 다양한 세포들이 위치 특이적 상처를 인지하고 특정 세포로의 분화를 결정할까?
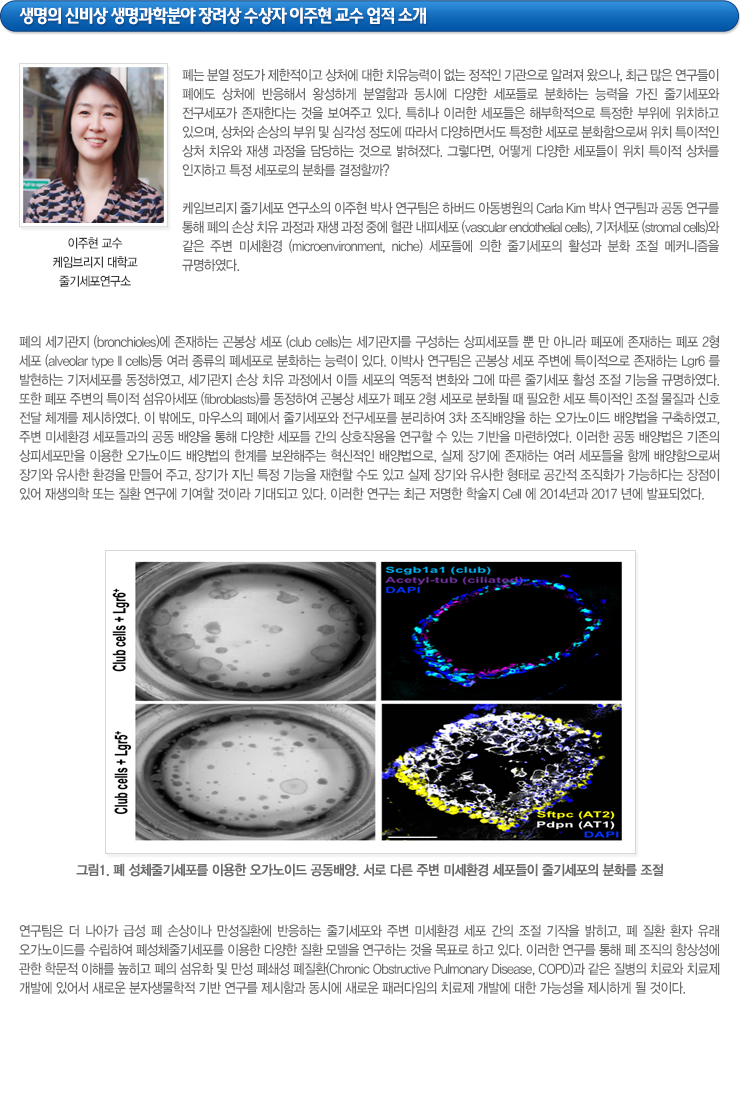
케임브리지 줄기세포 연구소의 이주현 박사 연구팀은 하버드 아동병원의 Carla Kim 박사 연구팀과 공동 연구를 통해 폐의 손상 치유 과정과 재생 과정 중에 혈관 내피세포 (vascular endothelial cells), 기저세포 (stromal cells)와 같은 주변 미세환경 (microenvironment, niche) 세포들에 의한 줄기세포의 활성과 분화 조절 메커니즘을 규명하였다. 폐의 세기관지 (bronchioles)에 존재하는 곤봉상 세포 (club cells)는 세기관지를 구성하는 상피세포들 뿐 만 아니라 폐포에 존재하는 폐포 2형 세포 (alveolar type II cells)등 여러 종류의 폐세포로 분화하는 능력이 있다. 이박사 연구팀은 곤봉상 세포 주변에 특이적으로 존재하는 Lgr6 를 발현하는 기저세포를 동정하였고, 세기관지 손상 치유 과정에서 이들 세포의 역동적 변화와 그에 따른 줄기세포 활성 조절 기능을 규명하였다. 또한 폐포 주변의 특이적 섬유아세포 (fibroblasts)를 동정하여 곤봉상 세포가 폐포 2형 세포로 분화될 때 필요한 세포 특이적인 조절 물질과 신호 전달 체계를 제시하였다. 이 밖에도, 마우스의 폐에서 줄기세포와 전구세포를 분리하여 3차 조직배양을 하는 오가노이드 배양법을 구축하였고, 주변 미세환경 세포들과의 공동 배양을 통해 다양한 세포들 간의 상호작용을 연구할 수 있는 기반을 마련하였다. 이러한 공동 배양법은 기존의 상피세포만을 이용한 오가노이드 배양법의 한계를 보완해주는 혁신적인 배양법으로, 실제 장기에 존재하는 여러 세포들을 함께 배양함으로써 장기와 유사한 환경을 만들어 주고, 장기가 지닌 특정 기능을 재현할 수도 있고 실제 장기와 유사한 형태로 공간적 조직화가 가능하다는 장점이 있어 재생의학 또는 질환 연구에 기여할 것이라 기대되고 있다. 이러한 연구는 최근 저명한 학술지 Cell 에 2014년과 2017 년에 발표되었다.
연구팀은 더 나아가 급성 폐 손상이나 만성질환에 반응하는 줄기세포와 주변 미세환경 세포 간의 조절 기작을 밝히고, 폐 질환 환자 유래 오가노이드를 수립하여 폐성체줄기세포를 이용한 다양한 질환 모델을 연구하는 것을 목표로 하고 있다. 이러한 연구를 통해 폐 조직의 항상성에 관한 학문적 이해를 높히고 폐의 섬유화 및 만성 폐쇄성 폐질환(Chronic Obstructive Pulmonary Disease, COPD)과 같은 질병의 치료와 치료제 개발에 있어서 새로운 분자생물학적 기반 연구를 제시함과 동시에 새로운 패러다임의 치료제 개발에 대한 가능성을 제시하게 될 것이다.

- 홈페이지 : http://wwww.cic.re.kr
- 이메일 : cic@catholic.ac.kr
- Tel : 01-2258-8269~8270
- 메일 수신을 원치 않으실 경우 위 문의처로 연락 부탁 드립니다. -
